Коллаген, аминокислотный состав, особенности пространственной структуры
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Коллагены
(греч. kolla – клей, genes – рождающий)
Биороль:
основные гликопротеины соединительной ткани;
обеспечивают сопротивление растяжению;
поддержание специфической структуры органов и тканей (основная функция).
Выделено более 20 типов коллагенов (изоколлагенов).
Химический состав:
белковая часть:
ГЛИ (каждая третья аминокислота);
ПРО и ОН-ПРО (каждая пятая аминокислота);
ОН-ЛИЗ;
мало S-содержащих и ароматических аминокислота;
углеводная часть:
дисахарид: глюкоза + галактоза.
Структурная организация:
Первичная структура: одиночная полипептидная цепь в виде левозакрученной спирали, но водородных связей мало (обычно спираль стабилизируется именно НО связями, но в составе много ПРО (необычная а/к, она не связывается с друмими а/к)).

Первичная структура коллагена
Вторичная структура: коллагеновый тип (особый тип пространственной структуры) – суперспираль:
3 полипептидные цепи сворачиваются в тройную линейную правозакрученную спираль → тропоколлаген.
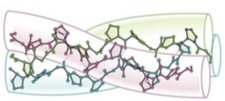
Вторичная структура коллагена
Третичная структура: расположение молекул тропоколлагена по горизонтали «хвост – голова» со сдвигом на 14.

Третичная структура коллагена
Четвертичная структура: ассоциация молекул тропоколлагена по вертикали (мостики между вагонами).

Четвертичная структура коллагена
Коллаген синтезируется матрично на полисомах (это белок!) в виде препроколлагена.
Процессинг препроколлагена
Внутриклеточно:
сигнальная пептидаза удаляет сигнальный пептид (пре-) → проколлаген;
гидроксилазы добавляют ОН-группы в ПРО и ЛИЗ;
гликозилтрансферазы присоединяют сахара (глюкоза, галактоза) к ОН-ЛИЗ;
в дополнительных пептидах (про-) образуются внутрии межцепочечные S-S связи;
образование тройной спирали → тропоколлаген.
Внеклеточно:
экзопептидазы удаляют дополнительные пептиды (про-) → коллаген;
образование фибрилл (плетение сети, фибриллогенез; в итоге – коллагеновые волокна с поперечной исчерченностью), связи – нековалентные (как фибрин S);
оксидазы удаляют ε-NH2 группы (окислительное дезаминирование) в ЛИЗ и ОН-ЛИЗ → образуются альдегидные группы;
альдегидные группы образуют поперечные ковалентные связи между волокнами коллагена (по аналогии с фибрином I).
Важно, что фибриллы образуются уже вне клетки.
