Механизм действия ферментов и ферментативная кинетика. Уравнения Михаэлиса-Ментен и Лайнуивера-Бэрка
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Теории взаимодействия субстрата и активного центра фермента
Э. Фишер.
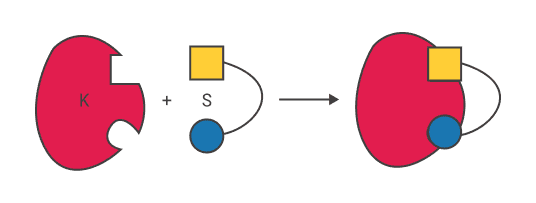
Теория Фишера
Теория Кошланда.
изменение конформации как субстрата, так и фермента;
комплиметарность субстрата и фермента;
электростатическое соответствие, обусловленное временем действия противоположно заряженных групп субстрата и активного центра фермента.
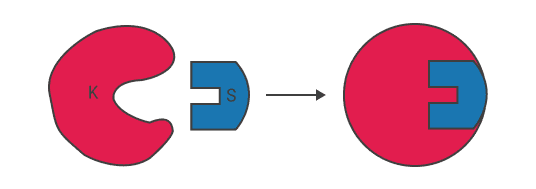
Теория Кошланда
Михаэлис, Ментен (1913 г.) изучали
Исследование влияния концентрации субстрата на активность фермента позволило во многом объяснить механизм действия фермента. При постоянной концентрации фермента начальная скорость реакции растет пропорционально увеличению концентрации субстрата (реакция первого порядка для низких концентраций субстрата).
При высоких концентрациях скорость реакции достигает своего максимального значения (Vmax) и не зависит от концентрации субстрата (реакция нулевого порядка).

Эта кривая описывается
Км — это константа Михаэлиса. Она численно равна той концентрации субстрата, при которой скорость реакции составляет половину от максимального значения. С помощью Км можно характеризовать сродство данного фермента к данному субстрату. Чем меньше Км, тем больше сродство фермента к данному субстрату. Если Км высока, то это означает, что сродство фермента к такому субстрату низкое и реакция при небольших концентрациях субстрата протекает неэффективно. Если V=1/2Vmax, то Km=[S], концентрация субстрата ммоль/л.
Определение Vmax и Km в координатах Лайнуивера-Берка, или координатах двойных обратных велечин. Линия отсекает точечные значения Km и Vmax, соответственно на осях обсцисс и ординат. На
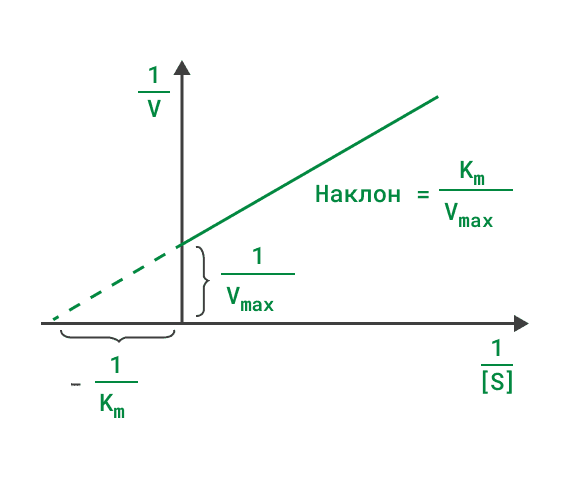
Уравнение Лайнуивера-Бэрка
