Методы разделения белков, пептидов, аминокислот
НАВИГАЦИЯ ПО СТРАНИЦЕ
Электрофорез
Данный метод основан на различной скорости миграции белков и пептидов в электрическом поле в зависимости от заряда. Носителями для электрофореза могут служить гели, ацетатцеллюлоза, агар.
Разделяемые молекулы движутся в геле в зависимости от размера: те из них, которые имеют большие размеры, будут задерживаться при прохождении через поры геля. Меньшие молекулы будут встречать меньшее сопротивление и, соответственно, двигаться быстрее.
В результате, после проведения электрофореза, большие молекулы будут находиться ближе к старту, чем меньшие.
Методом электрофореза можно разделить белки по молекулярной массе. Для этого используют электрофорез в ПААГ в присутствии додецилсульфата натрия (ДДS-Na). ДДС-Na является дифильным веществом и содержит заряженную группу и гидрофобную. Белки связываются с ДДС-Na своими гидрофобными радикалами и при этом денатурируют. Таким образом, белки выравниваются по форме и заряду. После этого подвижность белка при электрофорезе зависит только от его молекулярной массы.
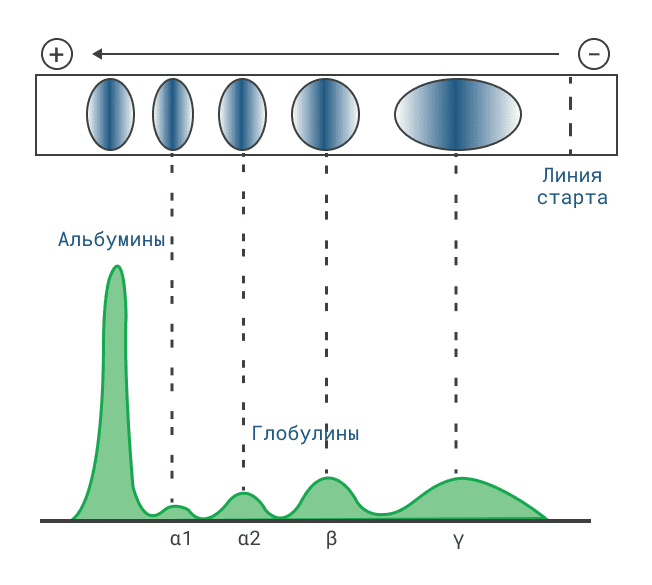
Электрофорез белков крови
Ионообменная хроматография
Неподвижная фаза имеет заряженные группы: катионит «-» и анионит «+».
Ионообменные смолы – производные полистирола, целлюлозы, агаразы.
Этапы:
Смолу заряжают.
Через катионит пропускают р-р NaCl, и Na+ садится на гранулы смолы (это делают для того, чтобы весь катионит был повязан только ионами Na+, потому что в водной среде и смоле могут быть другие положительно заряженные катионы).
Белок помещают в беферный растворм (рН=3), все белки заряжены «+».
Пропускают смесь белка через колонку: -NH3-группы белка вытесняют Na+ и связываются со смолой.
Возрастающими концентрациями NaCl белки, имеющие наименьший «+» заряд (много асп и глу), выходят из колонки первыми, за ними – белки, где много нейтральных аминокислот; белки, связанные со смолой наиболее прочно (много арг, лиз и гис), выходят последними.
Адсорбционная хроматография
Основана на различиях в сорбируемости разделяемых белков адсорбентом (Al2O3, силикагель), и последующем вымывании этих белков соответствующими элементами.
Белки связываются с полярной поверхностью адсорбента полярными группами, поэтому легче вымыть более неполярные белки. Для этого используются неполярные элюенты (хлороформ, гексан, диэтиловый эфир).
Распределительная хроматография
С неподвижным носителем (крахмал, гель, бумага) химически связана стационарная (полярная) фаза.
Подвижная фаза – неполярная, которая служит растворителем.
Скорость движения молекул зависит от возможности растворяться в неполярном растворителе.
Вестерн-блот анализ (иммуноэлектрофорез)
В основе метода – принципы комплементарности и гибридизации.
Этапы:
Выделение белков из биологического материала.
Разделение белков по молекулярной массе методом электрофореза в ПААГ с ДДС-Na.
Перенос белков на ацетатцеллюлозу + груз сверху, получаем реплики белка на пластине (блоты пока не видны).
Обработка пластины раствором неспецифического белка, чтобы «забить» оставшиеся поры.
Обработка раствором первичных антител (это антитела к искомому белку), они связываются с искомым белком, если он есть.
Промывка (для удаления не связавшихся антител).
Обработка раствором меченых вторичных антител (молекулярный зонд).
Промывка для удаления несвязавшихся вторичных антител.
Проявка: авторадиография (или обработка пластины раствором субстрата).
Применение: диагностика ВИЧ, гепатита, выделение индивидуальных белков, в судебно-медицинской экспертизе.

![Zaka-zaka [CPS] RU + CIS](/_nuxt/img/zaka-2.c18a627.png)



