Атомная орбиталь. Квантовые числа
НАВИГАЦИЯ ПО СТРАНИЦЕ
Строгое математическое описание в рамках квантово-механической модели требует сложного математического аппарата. Для описания состояния электрона в атоме мы будем пользоваться параметрами, именуемыми квантовыми числами.
Главное квантовое число (n)
Главное квантовое число определяет энергетический уровень и размер электронного облака, чем больше n тем больше электронное облако.
Возможные значения n: 1,2,3...
Побочное (орбитальное) квантовое число (l)
Побочное квантовое число определяет энергетический подуровень и форму электронного облака.
Возможные значения l: 0,1...n-1
Таким образом, для различных n имеется различный набор l:
n | l |
|---|---|
1 | 0 |
2 | 0, 1 |
3 | 0, 1, 2 |
4 | 0, 1, 2, 3 |
Для l, однако, принято использовать буквенные обозначения:
l | Буква |
|---|---|
0 | s |
1 | p |
2 | d |
Здесь хорошо видно, что количество энергетических подуровней задается номером уровня. Первый энергетический уровень состоит лишь из s-подуровня, второй и s- и p-подуровней, третий из s-, p- и d-подуровней и т.д.
Форма орбиталей с различным орбитальным квантовым число — различна.
Порядок заселения орбиталей (возрастания их энергии) описывается
Главное квантовое число (n) | Побочное квантовое число (l) | Орбитали | n+l |
|---|---|---|---|
1 | 0 (s) | 1s | 1 |
2 | 0 (s) | 2s | 2 |
1 (p) | 2p | 3 | |
3 | 0 (s) | 3s | 3 |
1 (p) | 3p | 4 | |
2 (d) | 3d | 5 | |
4 | 0 (s) | 4s | 4 |
1 (p) | 4p | 5 | |
2 (d) | 4d | 6 | |
3 (f) | 4f | 7 |
Магнитное квантовое число (m)
Магнитное квантовое число определяет ориентацию в пространстве электронного облака.
Возможные значения m: -l...0…l
Таким образом, для различных значений l имеется различный набор m:
l | m |
|---|---|
s | 0 |
p | -1, 0, 1 |
d | -2, -1, 0, 1, 2 |
f | -3, -2, -1, 0, 1, 2, 3 |
Количество возможных различных ориентаций электронного облака в пространстве определяет количество орбиталей, которые могут сосуществовать на одном электронном уровне (обладать одинаковой энергией).
s-подуровень содержит одну орбиталь, p — три, d — пять, f — семь.
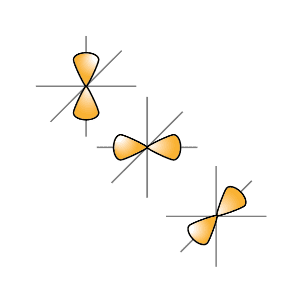
р-орбиталь
Спиновое квантовое число (ms)
Спиновое квантовое число определяет собственный момент импульса электрона и имеет исключительно квантовую природу.
Возможные значения : ±1/2
Запрет Паули в приложении к электронным оболочкам атомов можно сформулировать так: в электронной оболочке атома не может быть двух электронов, имеющих одинаковый набор квантовых чисел. Таким образом, электроны, расположенные на одном уровне (одинаковое главное квантовое число), подуровне (одинаковое побочное квантовое число), орбитали (одинаковое магнитное квантовое число), должны отличаться спиновым квантовым числом.
![Zaka-zaka [CPS] RU + CIS](/_nuxt/img/zaka-3.4c5f26a.png)




