Азот: строение, способы получения, химические свойства
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Строение атома азота
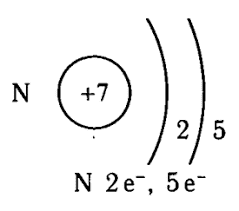
Азот – седьмой элемент периодической таблицы, расположенный в VА-группе во втором периоде. Относительная атомная масса равна 14.
Азот состоит из ядра с зарядом +7 и семи электронов, распределённых по двум энергетическим уровням. Нахождение элемента в пятой группе указывает на количество электронов на внешнем уровне.
Стоит заметить, что при этом высшая степень окисления для азота +5, а высшая
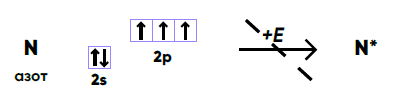
Таким образом, атом азота может проявлять валентности I, II, III и IV, но не V!
Простое вещество азот
Азот – бесцветный газ, не имеющий запаха. Растворяется в воде незначительно.
Молекула азота – двухатомная, атомы в ней связаны между собой прочной тройной связью: N ≡ N.
Такое строение определило низкую реакционную способность азота.
Азот — один из самых распространённых элементов на Земле. Азот в форме двухатомных молекул составляет большую часть атмосферы Земли, где его содержание составляет 75,6% по массе или 78,084% по объёму.
В белке животных и человека содержится около 16–17% азота. В организмах животных белок образуется за счет потребляемых белковых веществ, имеющихся в организмах травоядных животных и в растениях. Растения синтезируют белок, усваивая содержащиеся в почве азотистые вещества, главным образом, из азотистых удобрений.
Способы получения азота
В промышленности азот получается сжижением и фракционированной перегонкой воздуха по схеме, приведенной ниже:
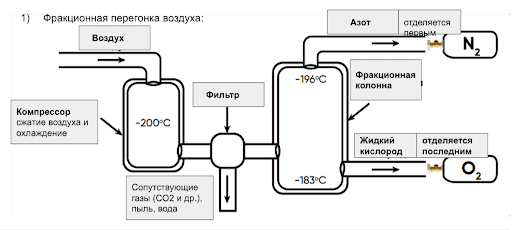
В лабораторной практике азот можно получить следующими способами:
Термическим разложением солей аммония:
;
.
С помощью окислительно-восстановительных реакций:
;
.
Окислением аммиака:
.
Химические свойства азота
Азот химически малоактивен из-за наличия упомянутой тройной связи. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
При определенных условиях азот способен взаимодействовать с неметаллами:
;
;
(только со ).
Обратите внимание, что азот не взаимодействует с серой.
Азот способен взаимодействовать с активными металлами. При этом при комнатной температуре протекает только реакция с литием:
.
Взаимодействие с другими металлами должно сопровождаться нагреванием:
.
