Азотная кислота. Получение. Окислительные свойства
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
— сильная одноосновная кислота, в водных растворах практически полностью диссоциирует на ионы.
Строение азотной кислоты
Степень окисления азота в азотной кислоте +5, а валентность IV.
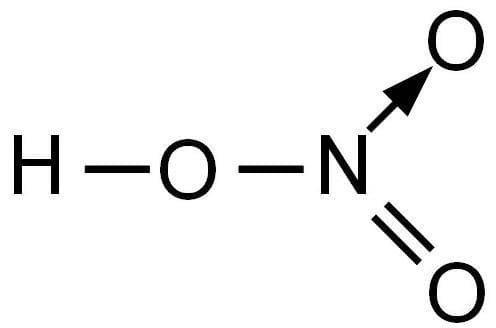
Вспомним, что на втором энергетическом уровне нет вакантных орбиталей, то атом азота не может распарить электронную пару на 2s, и соответственно не может повысить свои валентные возможности до V.
В молекуле между атомом азота и двумя атомами кислорода – две одинаковые полуторные связи.
Азот в находится в - гибридизации. Три гибридные орбитали азота образуют три связи с атомами кислорода, а одна негибридная p-орбиталь азота c p-орбиталями
кислорода образует общую электронную плотность. Порядок связи N – O будет равен 1,5.
Азот образует всего 4 связи и имеет валентность IV, несмотря на степень окисления +5
Физические свойства азотной кислоты
Азотная кислота – бесцветная гигроскопичная жидкость, хорошо растворима в воде, с резким запахом.
Способы получения азотной кислоты
В лаборатории азотную кислоту получают при взаимодействии концентрированной серной кислоты с твёрдыми нитратами щелочных металлов:
.
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
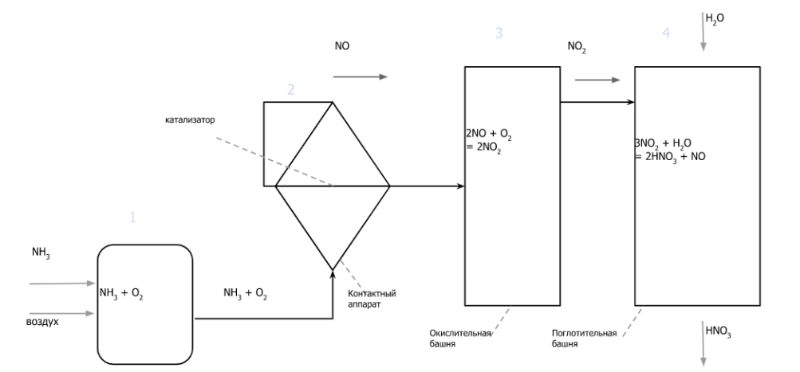
Очищенный аммиак смешивают с воздухом.
В контактном аппарате в присутствии катализатора происходит окисление аммиака до оксида азота(II):
.
Далее смесь, выходящая из контактного аппарата охлаждается и поступает в окислительную башню, где оксид азота(II) окисляется до оксида азота(IV):
.
Газовую смесь, содержащую оксид азота(IV), направляют в поглотительную башню. Вода в башню поступает сверху, а газовая смесь, содержащая оксид азота(IV) – снизу (принцип противотока). Таким образом, конечным этапом является поглощение диоксида азота водой в избытке кислорода:
.
Химические свойства азотной кислоты
Азотную кислоту не следует хранить в прозрачной посуде, так как на свету она разлагается на бурый газ, кислород и воду, приобретая желтоватый цвет:
.
Свойства, общие с другими кислотами.
Диссоциация в водном растворе:
.
Взаимодействие с основными и амфотерными оксидами:
;
.
Взаимодействие с основаниями и амфотерными гидроксидами:
;
.
Взаимодействие с солями более слабых кислот:
;
.
Специфические взаимодействия азотной кислоты
Азотная кислота обладает сильными окислительными свойствами за счет атома азота в высшей степени окисления +5.
C металлами. При взаимодействии с металлами не выделяется водород. В результате реакций образуется продукт восстановления нитрат-иона, соль и вода.
Состав продуктов восстановления зависит активности металла, концентрации кислоты и температуры. Чем активнее металл и чем более разбавлена кислота, тем глубже протекает восстановление азота.
Концентрированным считают раствор кислоты с концентрацией более 30% или выше. Независимо от активности металла реакция взаимодействия с концентрированной азотной кислотой протекает по схеме:
.
С концентрированной азотной кислотой не взаимодействуют благородные металлы (Au, Ru, Os, Rh, Ir, Pt, W), а ряд металлов (Al, Ti, Cr, Fe, Co, Ni) при низкой температуре пассивируются концентрированной азотной кислотой.
Пассивация, в данном случае, это образование прочной оксидной плёнки, которая предотвращает дальнейшее течение реакции.
Реакция возможна при повышении температуры, она протекает по схеме, представленной выше.
.
Продуктом восстановления азотной кислоты в разбавленном растворе (10-30%) может являться , , NO:
;
;
.
Продуктом восстановления азотной кислоты в очень разбавленном растворе с активными металлами является нитрат аммония :
.
Схематично можно представить следующим образом:
.
Активные металлы (Li – Al) | Металлы средней активности (Mn – Pb) | Малоактивные (Сu – Au) | |
|---|---|---|---|
Концентрированная | |||
Разбавленная | |||
Очень разбавленная | – |
Al, Cr, Fe не реагируют с холодной концентрированной ;
Au, Pt – не реагируют с .
С неметаллами. Азотная кислота проявляет окислительные свойства при взаимодействии с неметаллами. Как правило, неметаллы окисляются до соответствующих кислот (в которых неметалл принимает свою высшую степень окисления), а продуктом восстановления азота является NO или .
;
;
.
Со сложными веществами. Азотная кислота также показывает достаточно сильную окислительную способность: окисляет бромиды и йодиды до простых веществ, сульфиды до сульфатов, а также металлы в низших положительных степенях окисления.
;
.
