Электролиз расплавов и растворов электролитов
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Для проведения электролиза в раствор или расплав электролита, вводят электроды. При этом проводимость в растворе или расплаве обеспечивается ионами, образовавшимися в результате электролитической диссоциации. Катионы движутся к отрицательно заряженному электроду — катоду, анионы к положительно заряженному — аноду.
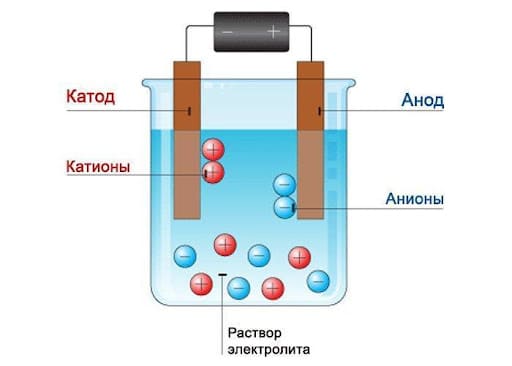
На катоде происходит процесс восстановления, на аноде — окисления.
Зачастую в ходе катодного и анодного процессов образуются вещества, способные реагировать между собой. Для предотвращения таких реакций используются разделенные электрохимические ячейки, где катодное и анодное пространство разделены мембраной или вовсе находятся в разных емкостях, соединенных токопроводящим мостиком.
Электролиз расплавов электролитов
В случае расплавов электролитов мы имеем дело только с ионами, входящими в состав электролита, что облегчает описание закономерностей электролиза.
На катоде происходит восстановление катиона, входящего в состав электролита.
На аноде происходит окисление аниона, входящего в состав электролита.
Рассмотрим несколько наиболее важных случаев.
Электролиз расплавов оксидов металлов
На катоде происходит восстановление металла: .
На аноде окисление кислорода: .
Например, электролиз расплава оксида алюминия в криолите:
;
.
Или суммарно (коэффициенты расставляем, используя метод электронного баланса):
.
Электролиз расплавов гидроксидов металлов
На катоде также протекает восстановление металла: .
На аноде же окисление гидроксо-групп: .
Например, электролиз расплава гидроксида натрия:
;
.
Или суммарно:
.
Электролиз расплавов солей
Как правило, электролизу подвергают соли бескислородных кислот (чаще всего — галогениды). Здесь, на катоде, протекает восстановление металла, а на аноде — восстановление аниона до простого вещества:
На катоде: .
На аноде:
Электролиз расплава хлорида кальция:
;
.
Электролиз растворов электролитов
В случае проведения электролиза растворов электролитов ситуация усложняется тем, что в ОВР, протекающих на электродах, могут участвовать молекулы воды.
На катоде может происходить восстановление металла или молекул воды. В случае растворов кислот происходит восстановление катионов водорода:
.
В случае растворов солей и оснований протекающий процесс зависит от относительной легкости восстановления катиона металла:
Активные металлы (до Al) | Металлы средней активности (от Al до Pb) | Малоактивные металлы (после H) | |
|---|---|---|---|
Катод |
Аналогичная ситуация наблюдается и для процессов, протекающих на аноде. Будет ли протекать окисление аниона электролита или молекул воды, определяется их относительной легкостью восстановления:
Гидроксид-анионы | Бескислородные анионы | Кислородсодержащие анионы и фторид-анионы | |
|---|---|---|---|
Анод |
Рассмотрим несколько примеров.
Электролиз соляной кислоты
;
.
.
Электролиз раствора сульфата меди
;
.
.
Электролиз с растворимым анодом
До этого, рассматривая закономерности протекания электролиза, мы полагали электроды инертными, т. е. не участвующими в химической реакции. К таким электродам относятся, например, платиновые или угольные электроды. Если же анод изготавливать из неинертного металла, то в ходе электролиза возможно его растворение в результате окисления. Т. е. к обычным процессам, протекающим на аноде, добавляется процесс окисления материала анода:
.
