Галогены. Электронное строение, простые вещества, способы получения
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Электронное строение атомов галогенов
Электронное строение внешнего электронного уровня галогенов описывается формулой . Так, электронное строение фтора в электронно-графической форме выглядит следующим образом:
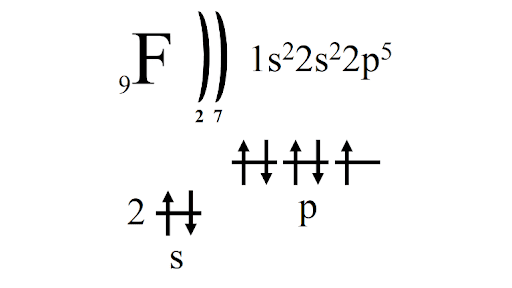
Возможные степени окисления: -1, 0.
Валентность в соединениях: I.
Аналогично для хлора:
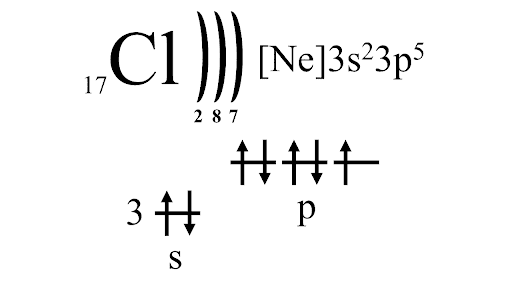
Возможные степени окисления: -1, 0, +1, +3, +5, +7.
Валентность в соединениях: I, III, V, VII.
Электронное строение и соответствующие характеристики для брома и иода аналогичны хлору.
Простые вещества галогенов
Простые вещества галогенов существуют в виде двухатомных молекул. Химическая связь в молекулах галогенов ковалентная неполярная (одинарная).
Двухатомная молекула фтора
Некоторые
Агрегатное состояние (25 °C) | Газ | Газ | Легколетучая жидкость | Легколетучее твердое вещество |
Цвет | Бледно-желтый | Желто-зеленый | Красно-коричневый | Темно-фиолетовый |
Токсичность | Токсичный | |||
Отношение к воде | Реагирует | Малорастворим, почти не реагирует | Малорастворим | |
Химическая связь | Ковалентная неполярная (одинарная) | |||
Способы получения галогенов
Как промышленные, так и лабораторные способы получения галогенов основаны на окислении галогенидов.
Лабораторные способы получения
Получение хлора. В лаборатории для получения хлора используют взаимодействие соляной кислоты с сильными окислителями, такими как , , и др., например:
.
Получение брома и иода. Для получения брома и иода используют взаимодействие иодидов и бромидов с окислителями в кислой среде:
;
.
Промышленные способы получения
Получение фтора. Для получения фтора используют электролиз расплава соединения . Формально процесс протекает в соответствии с уравнением реакции:
.
Получение хлора. Главным способом получения хлора в промышленности является электролиз раствора хлорида натрия:
.
Получение брома. Бром в промышленности получают действием хлора на бромиды:
.
Получение иода. Водоросли — один из основных источников иода. Иод выделяют из них, действуя на сырье диоксидом марганца в кислой среде:
.
