Галогены. Химические свойства
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Галогены — активные окислители, взаимодействуют практически со всеми элементами и многими сложными веществами. Окислительная способность в ряду галогенов падает с ростом радиуса атома от фтора к иоду.
Взаимодействие с простыми веществами
Галогены вступают в реакции с большинством простых веществ, проявляя при этом свои окислительные свойства.
Многие реакции, несмотря на высокую активность галогенов, требуют дополнительного внешнего воздействия, например, УФ-излучения или повышенной температуры.
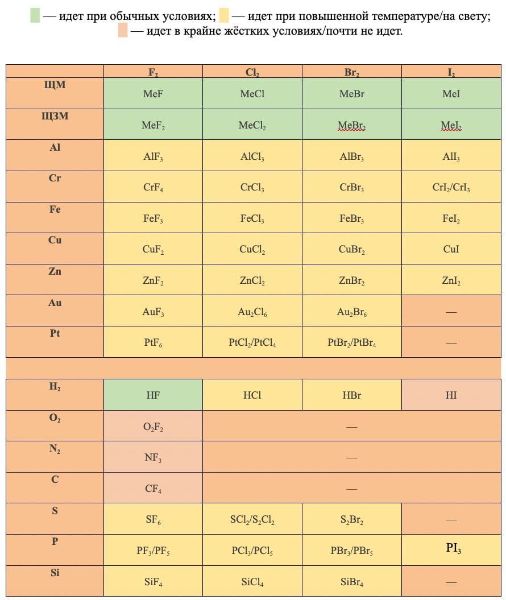
Продукты некоторых реакций простых веществ галогенов с простыми веществами металлами и неметаллами
Например:
= зеленая клетка, значит, реакция идет без дополнительных условий:
.
= желтая клетка, значит, нужны дополнительные условия:
.
Взаимодействие со сложными веществами
Галогены вступают в разнообразные ОВР с участием сложных веществ, проявляя, как правило, окислительные свойства. Для хлора, брома и иода также характерны реакции диспропорционирования в нейтральных и щелочных растворах.
Взаимодействие с водой. Фтор активно окисляет воду:
.
Хлор, бром и иод ограниченно растворяются в воде. Растворение сопровождается диспропорционированием, однако лишь для хлора этот процесс протекает хоть в сколько-нибудь заметной степени:
.
Растворы хлора, брома и иода в воде называют хлорной, бромной и иодной водой соответственно.
Взаимодействие со щелочами.Диспропорционирование хлора, брома и иода значительно усиливается в присутствии щелочей.
При пониженной температуре хлор диспропорционирует в соответствии с уравнением реакции:
.
При повышенной температуре диспропорционирование протекает глубже:
.
Бром ведет себя аналогично хлору, гипоиодиды же в растворах оказываются крайне неустойчивы. Таким образом, для иода протекает только реакция, аналогичная взаимодействию хлора с горячим раствором щелочи.
Взаимодействие с галогенидами. Более активный галоген способен вытеснять менее активный из его галогенидов (для фтора, однако, невозможно провести реакцию в водном растворе). Например, хлор способен вытеснять бром и иод:
;
.
