Химическая кинетика. Скорость химической реакции
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Природа реагирующих веществ
Некоторые вещества вступают в реакции быстрее (просто потому, что по своей природе они активнее).
Например, чем активнее металл, тем быстрее он реагирует с кислотой.

Мы видим, что кальций активнее, чем железо, поэтому он активнее (быстрее) будет реагировать с кислотой.
Или при взаимодействии серной и уксусной кислот с цинком, реакция будет протекать быстрее в случае с серной кислотой, так как она является сильной, а уксусная — слабой.
Концентрация
Чем больше концентрация реагентов, тем выше скорость реакции. Концентрации продуктов не влияют на скорость реакции.
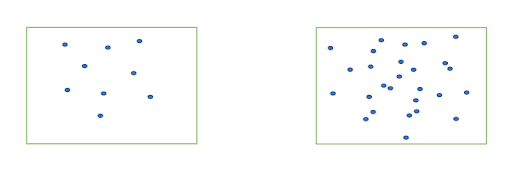
Если представить два одинаковых сосуда и поместить в один из них 10 молекул, а в другой 1 000, то чаще сталкиваться будут молекулы в сосуде, где их концентрация больше:
Температура
Чем выше температура, тем выше скорость реакции. При повышении температуры происходит возрастание числа активных столкновений молекул. Вследствие чего разрываются и образуются связи.
Наиболее простым способом количественного описания изменения скорости химической реакции при увеличении температуры является эмпирическое правило Вант-Гоффа — при повышении скорости химической реакции на каждые 10 градусов по цельсию, её скорость увеличивается в 2-4 раза. Математически это можно выразить следующим образом:
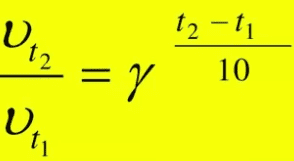
где γ — температурный коэффициент Вант-Гоффа, для большинства реакций он имеет значения от 2 до 4.
Площадь поверхности соприкосновения реагирующих веществ
(влияет на реакции с участием твёрдых веществ)
Чем больше площадь соприкосновения реагирующих веществ, тем выше скорость реакции. Измельчение твердого вещества увеличивает площадь соприкосновения реагентов, следовательно, увеличивается скорость реакции.
Давление и объем
(влияет на реакции с участием газообразных веществ)
Давление и объем — обратно пропорциональные факторы.
С увеличением давления происходит уменьшение реакционного сосуда, следовательно, увеличивается число молекул на единицу объема.
То есть с увеличением давления увеличивается скорость реакции. А с увеличением объема — скорость реакции уменьшается.
Катализаторы и ингибиторы
Катализаторы — вещества, которые не расходуются в ходе реакции, но ускоряют ее прохождение. Работа катализатора направлена на снижение энергии активации, что приводит к увеличению числа столкновений, имеющих достаточную энергию для инициирования химической реакции.
Ингибиторы, наоборот, замедляют химические реакции.
