Кислоты: классификация, номенклатура
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка.
Классификация кислот
Существует большое количество способов классификации кислот, рассмотрим основные из них.
По составу:
Кислородсодержащие кислоты. Кислоты, в составе которых имеются атомы кислорода (, , и т.д.)
Бескислородные кислоты. Кислоты, в составе которых атомы кислорода отсутствуют (, , и т.д.)
По количеству атомов водорода, способных замещаться на металл.
Одноосновные кислоты – содержат один атом водорода, способный замещаться на металл (, и т.д.)
Двухосновные кислоты – содержат два атома водорода, способных замещаться на металл (, и т.д.)
Трехосновные кислоты – содержат три атома водорода, способных замещаться на металл ( и т.д.)
Но не стоит определять основность только по числу атомов водорода, ведь не каждый такой атом способен замещать металл. Например, фосфорноватистая кислота является одноосновной кислотой. Так как на металл способен замещаться только один атом водорода в гидроксильной группе, а два других связаны непосредственно с фосфором и на металл не замещаются.
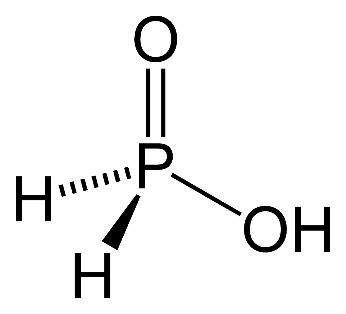
Фосфорноватистая кислота
Аналогичная ситуация и с фосфористой кислотой . Эта кислота является двухосновной кислотой, посмотрите на её строение:
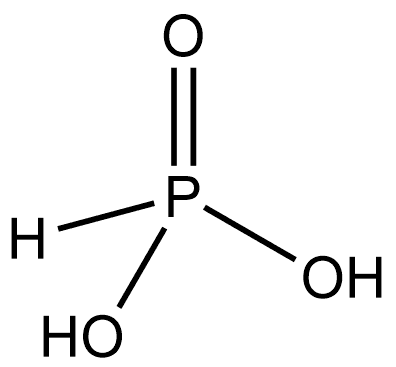
Фосфористая кислота
По степени диссоциации в водном растворе.
Сильные кислоты – кислоты, являющиеся сильными электролитами (, , , , , , , , , , , ).
Слабые кислоты – кислоты, являющиеся слабыми электролитами (, , , , , , , ).
Кроме того, существуют такие критерии, как летучесть и устойчивость.
Летучие кислоты – кислоты, которые испаряются из раствора со временем.
Нелетучие – кислоты, стабильные в водных растворах.
Устойчивые кислоты – те, которые могут существовать в свободном виде.
Неустойчивые – те, которые не существуют в свободном виде (распадаются на газ и воду) (, ).
Для того, чтобы правильно называть кислоты (а в дальнейшем и соли), необходимо выучить таблицу:
Номенклатура кислот и кислотных остатков
Названия кислот | Формулы кислот | Названия кислотных остатков | Формулы кислотных остатков |
|---|---|---|---|
Плавиковая / фтороводородная | фторид | ||
Соляная / хлороводородная | хлорид | ||
Бромоводородная | бромид | ||
Иодоводородная | иодид | ||
Сероводородная | сульфид | ||
Циановодородная / синильная | цианид | ||
Серная | сульфат | ||
Сернистая | сульфит | ||
Азотная | нитрат | ||
Азотистая | нитрит | ||
Мышьяковая | арсенат | ||
Фосфорная / ортофосфорная | фосфат | ||
Фосфористая (орто) | фосфит | ||
Фосфорноватистая (орто) | гипофосфит | ||
Угольная | карбонат | ||
Кремниевая | силикат | ||
Уксусная | ацетат | ||
Хлорная | перхлорат | ||
Хлорноватая | хлорат | ||
Хлористая | хлорит | ||
Хлорноватистая | гипохлорит | ||
Марганцовая | перманганат | ||
Марганцовистая | манганат | ||
Хромовая | хромат | ||
Дихромовая | дихромат |
Помимо основной таблицы, можно запомнить некоторые
Как меняется окончание в зависимости от степени окисления центрального атома:

Например:
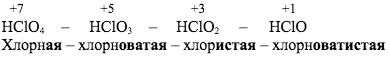
Как меняется приставка в зависимости от количества гидроксильных групп (при одинаковой степени окисления центрального атома):

Например:
Ортофосфорная –
Метафосфорная –
Также используют приставку пиро- для кислот, содержащих свыше одного атома кислотообразующего элемента в одной и той же степени окисления, например, пирофосфорная кислота , пиросерная кислота.
