Медь
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Медь — металл, элемент с порядковым номером 29, расположен в 4 периоде IB группе Периодической системы химических элементов Д. И. Менделеева.
Электронное строение меди
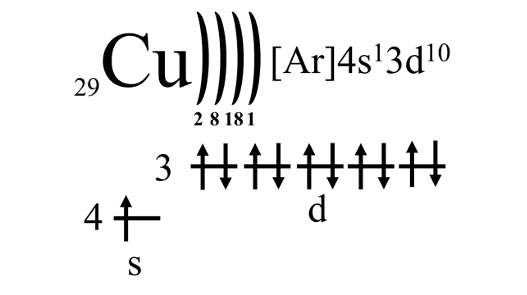
Возможные степени окисления: +2, +1, 0.
Следует обратить внимание, что у меди наблюдается т. н. проскок электрона, заключающийся в «переходе» одного электрона с внешнего 4s-подуровня на 3d-подуровень. Он обусловлен повышенной устойчивостью конфигурации с полностью заполненным подуровнем.
Химические свойства меди
Медь — малоактивный металл золотисто-розового цвета, в химические реакции вступает неохотно, химически медь довольно инертна.
Взаимодействие с неметаллами.
При повышенной температуре реагирует с некоторыми наиболее активными неметаллами:
;
;
;
.
При более высоких температурах образуются оксид и сульфид меди(I):
;
.
Взаимодействие со сложными веществами.
С водой, растворами кислот и щелочей во взаимодействие не вступает. Подвержена действию лишь концентрированных кислот-окислителей, при этом восстановление последних минимально: серной — до , азотной — до .
Вытесняет из растворов солей менее активные металлы, способна восстанавливать соли железа(III):
;
.
Получение меди
Медь преимущественно получают в ходе гидрометаллургического процесса — восстановлением из водных растворов солей действием металлического железа:
.
Применяют также и электролитический способ получения:
.
Окислительно-восстановительные свойства соединений меди
Соединения меди в степени окисления +1 неустойчивы, в растворе склонны диспропорционировать:
.
Степень окисления +2 более характерна для меди. В таком состоянии медь обладает слабыми окислительными свойствами. Растворы солей меди(II) окисляют более активные металлы, иодиды (из-за чего иодид меди(II) не может быть получен), фосфин и другие сильные восстановители:
.
