Механизмы образования химической связи
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Отдельные атомы могут соединяться, образуя более сложные химические частицы, в таком случае говорят, что атомы связаны между собой.
Причина образования химических связей кроется в «желании» атомов получить завершенную электронную оболочку, соответствующую электронной конфигурации благородных газов. Некоторым элементам, расположенным в начале периода, для этого проще отдать свои электроны, другим, находящимся в середине и конце периода, забрать недостающие электроны.
Типы химической связи
Химические связи могут быть классифицированы на основании природы их возникновения, здесь выделяют:
Ковалентную химическую связь.
Ионную химическую связь.
Металлическую химическую связь.
Ковалентная связь
Ковалентная связь – тип химической связи, образованной за счет общей электронной пары.
Существует два различных механизма образования ковалентной связи.
Обменный механизм – каждая из частиц, участвующих в образовании связи предоставляет один неспаренный электрон.
Например, обменный механизм реализуется при образовании молекулы водорода. Каждый из атомов водорода имеет один неспаренный электрон, предоставляемый для образования связи. Образуя химическую связь, каждый из атомов водорода становится равноправным владельцем общей электронной пары, удовлетворяя свою потребность в получении заполненного внешнего электронного уровня.
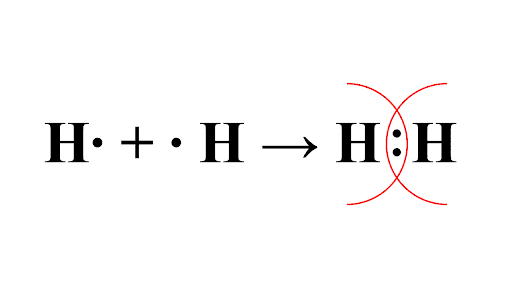
Обменный механизм ковалентной связи
Донорно-акцепторный механизм – одна из частиц, участвующих в образовании связи, предоставляет электронную пару, а другая – свободную орбиталь.
Донор — элемент, предоставляющий пару электронов (например, азот или бор).
Акцептор — элемент, предоставляющий свободную орбиталь для пары электронов другого атома
Например, образование катиона аммония из молекулы аммиака и катиона водорода. Атом азота аммиака имеет неподеленную электронную пару, а катион водорода – свободную орбиталь.
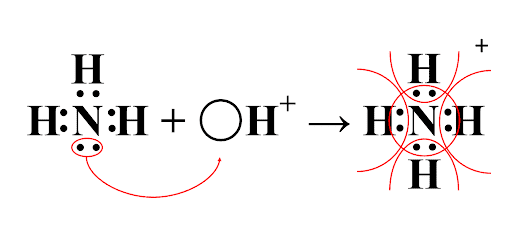
В результате образования катиона аммония атом азота «окружает» себя восемью электронами, каждый атом водорода – двумя, т.е. все атомы удовлетворяют свою потребность в получении заполненного внешнего электронного уровня.
Кроме того, что существует два различных механизма образования ковалентной связи, выделяют также два ее различных типа:
Ковалентная неполярная химическая связь – ковалентная связь, образованная между атомами с одинаковой электроотрицательностью (атомами одного элемента). Реализуется в соединениях, содержащих связь между одинаковыми атомами неметаллов.
Ковалентная полярная химическая связь – ковалентная связь, образованная между атомами с различной электроотрицательностью. Реализуется между атомами различных неметаллов.
В случае ковалентной полярной связи происходит смещение электронов в сторону более электроотрицательного атома, при этом он приобретает некоторый отрицательный заряд, а менее электроотрицательный атом приобретает положительный заряд. Поскольку в большинстве случаев нет необходимости знать точное значение заряда, который несет атом, используют формализованное понятие степени окисления.
За счет ковалентных связей атомы связываются в молекулы в четком соотношении, для веществ, имеющих молекулярное строение, выполняется закон постоянства состава – состав химического соединения не зависит от способа получения, отношение количества атомов в молекуле постоянно и выражается целыми числами. Соединения, для которых выполняется закон постоянства состава, называют дальтонидами.
Ионная химическая связь
Ионная химическая связь – идеализированное понятие, предельный случай ковалентной полярной связи, когда все общие электроны полностью смещены к более электроотрицательному атому, имеет электростатическую природу.
Реализуется в соединениях типичных металлов с типичными неметаллами и некоторых других.
Ионные соединения можно представить так:
Например, при образовании связи между натрием и хлором единственный валентный электрон натрия переходит к хлору, хлор завершает свой внешний электронный уровень, натрий в то же время получает электронную оболочку предыдущего благородного газа.
Для ионных соединений, в общем случае, закон постоянства состава не выполняется, что объясняется электростатической природой ионной связи, которая, в отличие от ковалентной связи, не насыщаема, т.е. один и тот же ион может связываться с различным количеством одинаковых противоионов. Однако для простоты их состав часто записывают постоянным простым соотношением. Соединения, для которых закон постоянства состава не выполняется, называют бертоллидами.
Металлическая химическая связь
Металлическая химическая связь – связь, существующая в простых веществах металлах и их сплавах, образуется за счет обобществления всех валентных электронов всех атомов металла.
Свободно перемещающиеся валентные электроны связывают между собой образовавшиеся в результате обобществления электронов ионы металла. Описанная природа металлической связи объясняет такие свойства металлов, как тепло- и электропроводность, металлический блеск.
