Металлы главных подгрупп. Щелочные металлы
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Электронное строение щелочных металлов
Электронное строение внешнего электронного уровня атомов ЩМ описывается формулой ns1. Так, электронное строение лития в электронно-графической форме выглядит следующим образом:
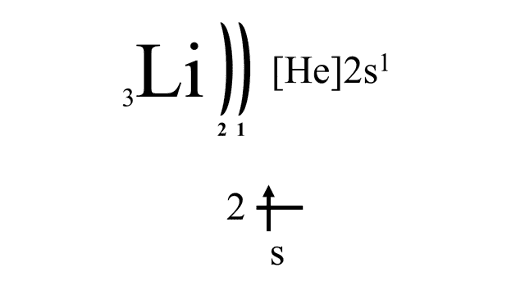
Электронные конфигурации остальных ЩМ аналогичны.
Возможные степени окисления: +1, 0.
Валентность в соединениях: I.
Химические свойства щелочных металлов
Щелочные металлы — чрезвычайно активные металлы, обладающие очень высокой восстановительной способностью. Легко вступают в химические реакции с неметаллами и многими сложными веществами.
Взаимодействие с неметаллами. При взаимодействии с большинством неметаллов образуют бинарные соединения:
С водородом — гидриды ЭH.
С галогенами — галогениды ЭHal (Hal = F, Cl, Br, I).
Продукт взаимодействия с кислородом зависит от металла. Литий дает оксид, натрий — пероксид, а более тяжелые, преимущественно надпероксиды:
;
;
.
Оксиды ЩМ можно получить при восстановлении пероксидов и надпероксидов, например:
.
С серой — сульфиды .
С азотом и фосфором — нитриды и фосфиды . Причем при обычных условиях в реакцию c азотом вступает лишь литий, остальные ЩМ требуют повышенной температуры.
С углеродом и кремнием — карбиды и силициды различного состава.
Взаимодействие со сложными веществами.
ЩМ активно восстанавливают воду, реакция сопровождается выделением большого количества тепла и даже взрывом. При этом выделяется водород и образуется соответствующий гидроксид:
.
Взаимодействие ЩМ с водными растворами в целом и растворами кислот и солей в частности можно рассматривать лишь формально. В таких случаях в первую очередь будет протекать реакция ЩМ с водой. Так, в случае кислот можно рассмотреть два последовательных превращения:
;
.
Или суммарно:
.
Поэтому формально реакция щелочных металлов с растворами кислот протекает также, как и в случае других металлов.
Из-за бурного взаимодействия с водой щелочные металлы не применяют для восстановления менее активных металлов из растворов их солей.
При взаимодействии с концентрированной серной кислотой выделяется сероводород. При взаимодействии с азотной кислотой возможно образование оксида азота(I), молекулярного азота и нитрата аммония, в зависимости от концентрации кислоты.
;
;
;
.
ЩМ также восстанавливают аммиак, с выделением водорода и образованием соответствующего амида:
.
Способы получения
Из-за высокой химической активности ЩМ встречаются в природе исключительно в составе соединений. По тем же причинам невозможно подобрать химический восстановитель для эффективного выделения ЩМ в чистом виде. Поэтому используют электрохимическое восстановление расплавов солей (преимущественно хлоридов) ЩМ и щелочей:
;
.
Литий также получают химическим восстановлением из оксида:
.
