Периодический закон и периодическая система
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
В истории химии по мере открытия все большего количества химических элементов различными учеными предпринимались попытки их систематизировать.
Одним из первых некоторые закономерности в изменении химических свойств элементов обнаружил немецкий химик И. Деберейнер. Он объединил некоторые из известных элементов в
Триады Деберейнера
Триада | Атомная масса (1) | Атомная масса (3) | Среднее атомных масс (1) и (3) | Атомная масса (2) |
|---|---|---|---|---|
Li, Na, K | 7 | 39 | 23 | 23 |
Ca, Sr, Ba | 40 | 137 | 88,5 | 88 |
P, As, Sb | 31 | 122 | 76,5 | 75 |
S, Se, Te | 32 | 128 | 80 | 79 |
Cl, Br, I | 35,5 | 127 | 81,25 | 80 |
Еще одной интересной попыткой систематизировать химические элементы является
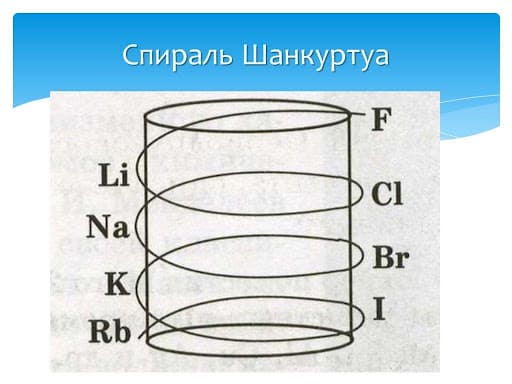
Чрезвычайно похожей на представление Д. И. Менделеева является
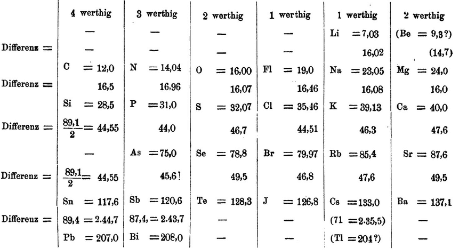
Таблица Мейера
Все эти (и другие, их было немало) способы систематизации химических элементов, вне всяких сомнений, выявляли некоторые закономерности в их свойствах. Однако никто из авторов подобных таблиц не смог найти тот закон, которому эти закономерности подчинены.
Наиболее удачный способ систематизации был предложен Д. И. Менделеевым, который сформулировал
Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса.
Во времена Менделеева еще не было известно о строении атома, однако в соответствии с современными представлениями основной характеристикой атома является не его атомный вес, а заряд ядра, поэтому следует переформулировать Периодический закон:
Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от заряда их ядра.
Огромное количество самых разных свойств, таких как: атомный радиус (зависимость атомного радиуса от порядкового номера элемента представлена ниже), температура плавления простых веществ, электроотрицательность, энергия атомизации и др. изменяются периодически с ростом заряда ядра атома.
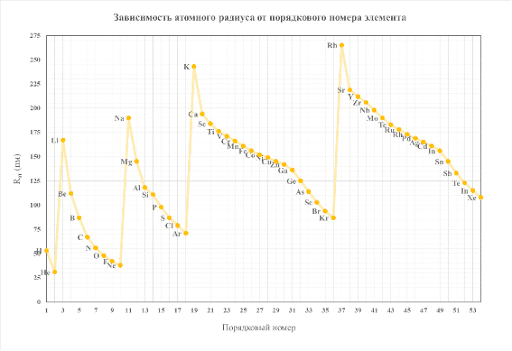
В работах Менделеева периодический закон обрел графическую форму, известную нам как Периодическая система химических элементов Д. И. Менделеева. Периодическая система может быть изображена графически различными способами, один из наиболее распространенных —
В рамках школьного курса химии обычно используют короткопериодный вариант.
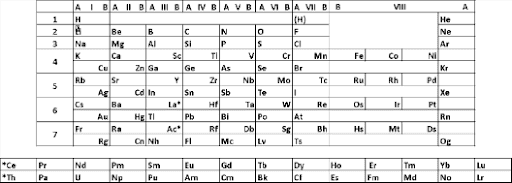
Короткопериодный вариант Периодической системы химических элементов
Д. И. Менделеев при составлении периодической системы не только установил порядок записи элементов в систему на основании их атомного веса, но и объединил элементы в группы на основании их химических свойств, поэтому вы можете заметить некоторые несоответствия, например, атомная масса кобальта несколько больше, чем у никеля. Расположение элементов в группы иллюстрирует периодичность изменения свойств химических элементов. Сейчас, вооружившись сведениями об электронном строении атомов, мы можем объяснить периодичность в изменении свойств периодичностью повторения строения внешнего электронного уровня. Так, например, электронную конфигурацию внешнего электронного уровня элементов IA группы можно выразить как .
Некоторые группы элементов (их называют
металлы IA группы — щелочные металлы;
элементы VA группы — пниктогены;
элементы VIA группы — халькогены;
элементы VIIA группы — галогены;
элементы VIIIA группы — благородные газы.
Таким образом, положение атома в Периодической системе определяется строением его атома, а значит, по нему можно судить о химических свойствах элемента.
Мы уже знаем, что с помощью периодической системы можно определить:
Заряд ядра атома — порядковый номер элемента.
Количество электронов в атоме в основном состоянии — порядковый номер элемента.
Количество заселенных электронных уровней в основном состоянии атома — номер периода, в котором расположен элемент.
Количество электронов на внешнем электронном уровне в основном состоянии атома — номер группы, в которой расположен элемент.
