Щелочноземельные металлы
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Электронное строение щелочноземельных металлов
Электронное строение внешнего электронного уровня атомов ЩЗМ описывается формулой ns2. Так электронное строение бериллия в электронно-графической форме выглядит следующим образом:
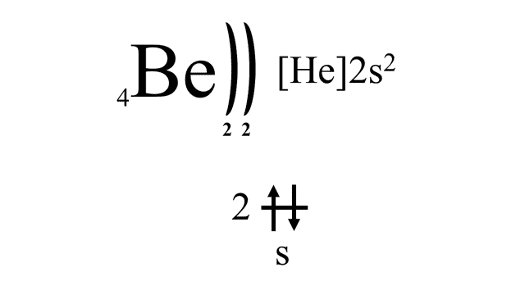
Электронные конфигурации остальных металлов IIA группы аналогичны.
Возможные степени окисления: +2, 0.
Валентность в соединениях: II.
Химические свойства щелочноземельных металлов
Щелочноземельные металлы — активные металлы (за исключением бериллия), обладающие высокой восстановительной способностью. Легко вступают в химические реакции с неметаллами и многими сложными веществами.
Взаимодействие с неметаллами.
С водородом (за исключения бериллия) — гидриды .
С галогенами — галогениды (Hal = F, Cl, Br, I).
С кислородом — оксиды . Пероксиды стронция и бария () могут быть получены действием избытка кислорода.
С серой — сульфиды .
С азотом и фосфором ЩЗМ, начиная с магния, образуют нитриды и фосфиды .
С углеродом и кремнием — карбиды и силициды различного состава. Наиболее часто среди карбидов встречаются метаниды, например, или ацетилениды, такие как .
Взаимодействие со сложными веществами.
ЩЗМ, за исключением бериллия, достаточно активно восстанавливают воду, однако, магний реагирует только с горячей водой. В ходе такого взаимодействия, как и в случае с ЩМ, выделяется водород и образуется соответствующий гидроксид:
.
Бериллий практически не взаимодействует с водой.
ЩЗМ активно взаимодействуют с растворами кислот и солей, восстанавливают оксиды металлов, особенно широко используется для этого магний. Процесс восстановления оксидов металлов под действием магния называют магнийтермией.
.
Поведение ЩЗМ, начиная с магния, при взаимодействии с кислотами окислителями аналогично ЩМ.
Бериллий находится на главной диагонали ПСХЭ, поэтому для него и его соединений характерна двойственность свойств. Бериллий взаимодействует с растворами щелочей, образуя при этом комплексные соли — тетрагидроксобериллаты, в составе которых валентность бериллия равна IV. Между бериллием и гидроксидными анионами реализуется ковалентная связь, образующаяся по донорно-акцепторному механизму.
.
При сплавлении со щелочами образует бериллаты:
.
Способы получения
Из-за высокой химической активности ЩЗМ в природе встречаются исключительно в составе соединений. В виду меньшей, чем у ЩМ активности, здесь восстановлением из оксида можно получать большее количество металлов, используют карбо- и алюмотермию:
.
В ходе восстановления оксида кальция с алюминием, в качестве промежуточного продукта образуется оксид алюминия. Оксид алюминия обладает амфотерными свойствами и тут же реагирует с оксидом кальция, образуя алюминат кальция :
.
Впрочем, электролиз расплавов солей также находит применение:
.
