Цинк
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Цинк — металл, элемент с порядковым номером 30, расположен в 4 периоде IIB группе Периодической системы химических элементов Д. И. Менделеева.
Электронное строение цинка
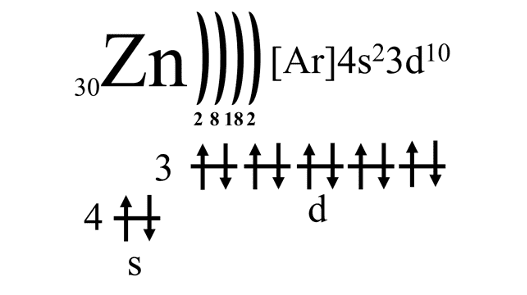
Возможные степени окисления: +2, 0.
Следует помнить, что поскольку 3d-электронный подуровень цинка полностью заполнен, его нельзя считать валентным. При образовании катиона электроны уходят с 4s подуровня, кроме того, в донорно-акцепторных взаимодействиях могут принимать участие только свободные 4p-орбитали.
Химические свойства цинка
Цинк — металл, находящийся на границе активных металлов и металлов средней активности. Достаточно легко вступает в химические реакции с неметаллами и многими сложными веществами.
Взаимодействие с неметаллами.
При взаимодействии с большинством неметаллов образует простые бинарные соединения (для большинства реакций требуется повышенная температура), например:
;
;
;
.
С другими типичными неметаллами, водородом, бором, углеродом, кремнием и азотом цинк во взаимодействие не вступает.
Взаимодействие со сложными веществами.
При обработке раскаленного цинка парами воды образуется оксид цинка и выделяется водород:
.
Активно взаимодействует с растворами кислот и солей менее активных металлов.
Вступает во взаимодействие с кислотами окислителями, при этом, в зависимости от условий реакции, может вести себя как металл средней активности, давая, например, S или при взаимодействии с концентрированной серной кислотой, так и как активный металл, восстанавливая серную кислоту до .
Способен к восстановлению многих металлов из оксидов:
.
Поскольку цинк обладает достаточно высокой активностью, а его оксид и гидроксид проявляют амфотерные свойства, алюминий взаимодействует и с растворами щелочей, образуя при этом комплексные соли — тетрагидроксоцинкаты, в составе которых валентность цинка равна IV. Механизм образования связи был описан нами ранее:
.
При взаимодействии с расплавами щелочей образуются цинкаты:
.
Получение цинка
Цинк получают карботермическим способом, восстанавливая оксид углеродом:
.
Либо электролизом растворов солей:
.
