Спектры испускания и поглощения
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Линейчатые спектры
Если пропустить солнечный свет через стеклянную призму или дифракционную решётку, то возникнет хорошо известный вам непрерывный спектр (рис. 1)

Рис. 1. Непрерывный спектр
Спектр называется непрерывным потому, что в нём присутствуют все длины волн видимого диапазона — от красной границы до фиолетовой. Мы наблюдаем непрерывный спектр в виде сплошной полосы, состоящей из разных цветов.
Непрерывным спектром обладает не только солнечный свет, но и, например, свет электрической лампочки. Вообще, оказывается, что любые твёрдые и жидкие тела (а также весьма плотные газы), нагретые до высокой температуры, дают излучение с непрерывным спектром.
Ситуация качественно меняется, когда мы наблюдаем свечение разреженных газов. Спектр перестаёт быть непрерывным: в нём появляются разрывы, увеличивающиеся по мере разрежения газа. В предельном случае чрезвычайно разреженного атомарного газа спектр становится линейчатым — состоящим из отдельных достаточно тонких линий.
Мы рассмотрим два типа линейчатых спектров: спектр испускания и спектр поглощения
Спектр испускания
Предположим, что газ состоит из атомов некоторого химического элемента и разрежен настолько, что атомы почти не взаимодействуют друг с другом. Раскладывая в спектр излучение такого газа (нагретого до достаточно высокой температуры), мы увидим примерно следующую картину (рис. 2):

Рисунок 2. Линейчатый спектр испускания
Этот линейчатый спектр, образованный тонкими изолированными разноцветными линиями, называется спектром испускания.
Любой атомарный разреженный газ излучает свет с линейчатым спектром. Более того, для каждого химического элемента спектр испускания оказывается уникальным, играя роль «удостоверения личности» этого элемента. По набору линий спектра испускания можно однозначно сказать, с каким химическим элементом мы имеем дело.
Поскольку газ разрежен и атомы мало взаимодействуют друг с другом, мы можем заключить, что свет излучают атомы сами по себе. Таким образом, атом характеризуется дискретным, строго определённым набором длин волн излучаемого света. У каждого химического элемента, как мы уже сказали, этот набор свой.
Спектр поглощения
Атомы излучают свет, переходя из возбуждённого состояния в основное. Но вещество может не только излучать, но и поглощать свет. Атом, поглощая свет, совершает обратный процесс — переходит из основного состояния в возбуждённое.
Снова рассмотрим разреженный атомарный газ, но на сей раз в холодном состоянии (при достаточно низкой температуре). Свечения газа мы не увидим; не будучи нагретым, газ не излучает — атомов в возбуждённом состоянии оказывается для этого слишком мало.
Если сквозь наш холодный газ пропустить свет с непрерывным спектром, то можно увидеть что-то вроде этого (рис. 3):

Рисунок 3. Линейчатый спектр поглощения
На фоне непрерывного спектра падающего света появляются тёмные линии, которые образуют так называемый спектр поглощения. Откуда берутся эти линии?
Под действием падающего света атомы газа переходят в возбуждённое состояние. При этом оказывается, что для возбуждения атомов годятся не любые длины волн, а лишь некоторые, строго определённые для данного сорта газа. Вот именно эти длины волн газ и «забирает себе» из проходящего света.
Более того, газ изымает из непрерывного спектра ровно те самые длины волн, которые излучает сам! Тёмные линии в спектре поглощения газа в точности соответствуют ярким линиям его спектра испускания. На рис. 4 сопоставлены спектры испускания и поглощения разреженных паров натрия:
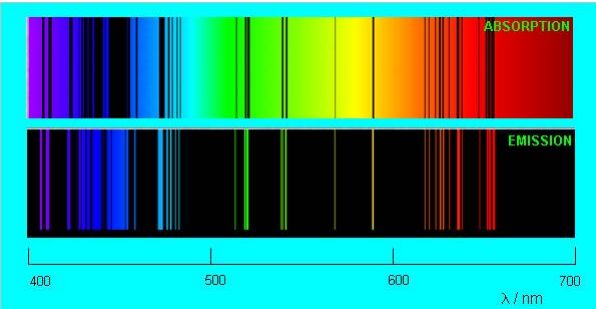
Рисунок 4. Спектры поглощения и испускания для натрия
Глядя на спектры испускания и поглощения, физики XIX века пришли к выводу, что атом не является неделимой частицей и обладает некоторой внутренней структурой. В самом деле, что-то ведь внутри атома должно обеспечивать механизм излучения и поглощения света!
Кроме того, уникальность атомных спектров говорит о том, что этот механизм различен у атомов разных химических элементов; стало быть, атомы разных химических элементов должны отличаться по своему внутреннему устройству.
