Методы, основанные на амплификации нуклеиновых кислот (ПЦР, этапы проведения)
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
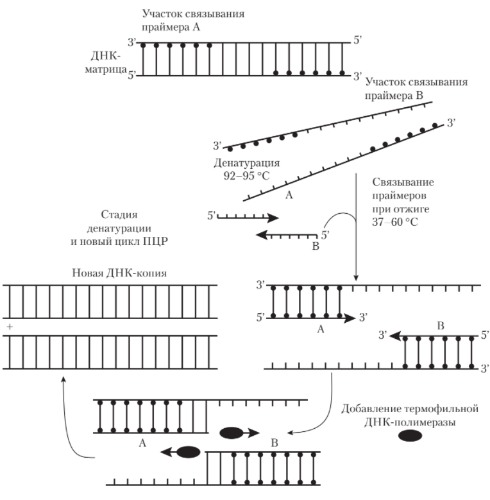
Полимеразная цепная реакция (ПЦР) позволяет обнаружить микроб в исследуемом материале (воде, продуктах, материале от больного) по наличию в нем ДНК микроба без выделения последнего в чистой культуре.
Для проведения этой реакции из исследуемого материала выделяют ДНК, в которой определяют наличие специфичного для данного микроба гена. Обнаружение гена осуществляют его накоплением. Для этого необходимо иметь праймеры комплементарного 3’-концам ДНК исходного гена. Накопление (амплификация) гена выполняется следующим образом. Выделенную из исследуемого материала ДНК нагревают, и она распадается на две нити. Добавляют праймеры. Смесь ДНК и праймеров охлаждают. При этом праймеры при наличии в смеси ДНК искомого гена связываются с его комплементарными участками. Затем к смеси ДНК и праймера добавляют ДНК-полимеразу и нуклеотиды. Устанавливают температуру, оптимальную для функционирования ДНК-полимеразы. В этих условиях в случае комплементарности ДНК гена и праймера происходит присоединение нуклеотидов к 3’-концам праймеров, в результате чего синтезируются две копии гена. После этого цикл повторяется снова, при этом количество ДНК гена будет увеличиваться каждый раз вдвое. Проводят реакцию в специальных приборах — амплификаторах.
ПЦР применяется для диагностики вирусных и бактериальных инфекций.
ПЦР в реальном времени — это ускоренный метод, при котором амплификация и определение продукта амплификации проводятся одновременно. Методика основана на том, что в амплификационную пробирку вводят молекулярный зонд, который в случае связывания с амплифицированной цепью генерирует флюоресцентный сигнал определенной длины волны. Реакция проводится в автоматическом режиме. ПЦР в реальном времени проводит полный анализ пробы в течение 20–60 мин. Метод позволяет обнаружить даже одну молекулу ДНК или РНК в пробе.
Используется для определения вирусной нагрузки, проведения молекулярного типирования.
Оценка молекулярно-генетических методов
Сферы использования молекулярно-генетических методов (МГМ):
диагностика инфекционных заболеваний;
химиотерапия и химиопрофилактика инфекционных заболеваний;
санитарная микробиология;
эпидемиология и инфекционный контроль;
биотехнология, в том числе вакционология. Систематика и эволюция микроорганизмов;
геномика и патогеномика.
Достоинства:
Высокая специфичность. Вывляют уникальные, характерные только для определенного вида микроорганизмов участки ДНК/РНК. Специфичность задаётся нуклеотидной последовательностью специфических праймеров.
Высокая чувствительность. Позволяют выявлять микроорганизмы, присутствующие даже в небольшом количестве (10–1000 клеток в пробе): на ранних стадиях заболеваний или при исследованиях донорской крови/органов.
Применяется, если другие методы невозможно использовать.
Для экспресс-диагностики не нужно выделять чистые культуры — это быстро.
Полная автоматизация и высокая производительность.
Низкая вероятность инфицирования персонала.
Недостатки:
Отсутствие международных протоколов по молекулярно-генетической диагностике различных нозологических форм заболеваний.
Необходимость разработки новых подходов к клинической интерпретации получаемых результатов.
Высокая стоимость оборудования.
