Фазовые переходы. Плавление и кристаллизация
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Фазовые переходы. Время: 0.18-1.24
Лёд, вода и водяной пар — примеры трёх агрегатных состояний вещества: твёрдого, жидкого и газообразного. В каком именно агрегатном состоянии находится данное вещество — зависит от его температуры и других внешних условий, в которых оно находится. При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы.
Фазовые переходы — изменения агрегатных состояний вещества тела.
Нас будут интересовать следующие фазовые переходы:
плавление (твёрдое тело → жидкость);
кристаллизация (жидкость → твёрдое тело);
парообразование (жидкость → пар);
конденсация (пар → жидкость).
Плавление и кристаллизация
Большинство твёрдых тел являются кристаллическими, т. е. имеют кристаллическую решётку.
Частицы (атомы или молекулы) кристаллического твёрдого тела совершают тепловые колебания вблизи фиксированных положений равновесия — узлов кристаллической решётки.
Например, узлы кристаллической решётки поваренной соли NaCl — это вершины кубических клеток «трёхмерной клетчатой бумаги» (см. рис. 1, на котором шарики большего размера обозначают атомы хлора); если дать испариться воде из раствора соли, то оставшаяся соль будет нагромождением маленьких кубиков.
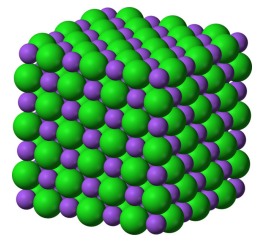
Рисунок 1. Кристаллическая решётка NaCl
Расплавить можно любое тело — для этого нужно нагреть его до температуры плавления, которая зависит лишь от вещества тела, но не от его формы или размеров. Температуру плавления данного вещества можно определить из таблиц. Наоборот, если охлаждать жидкость, то рано или поздно она перейдёт в твёрдое состояние.
Превращение жидкости в кристаллическое твёрдое тело называется
Таким образом, плавление и кристаллизация являются взаимно обратными процессами. Температура, при которой жикость кристаллизуется, называется температурой кристаллизации. Оказывается, что температура кристаллизации равна температуре плавления: при данной температуре могут протекать оба процесса. Так, при 0 ◦C лёд плавится, а вода кристаллизуется; что именно происходит в каждом конкретном случае — зависит от внешних условий (например, подводится ли тепло к веществу или отводится от него).
