Реальный газ. Изотермы реального газа. Уравнение Ван-дер-Ваальса
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Реальный газ – это газ, свойства которого существенно зависят от взаимодействия молекул.
Взаимодействие между молекулами реального газа носит сложный характер, поэтому получить уравнение состояния, которое бы количественно правильно описывало поведение реального газа во всей области возможных изменений его температуры и плотности, не представляется возможным. Можно, однако, записать приближенное уравнение, которое учитывает основные качественные особенности взаимодействия молекул.
Уравнение Ван-дер-Ваальса – уравнение состояния реального газа, которое удовлетворительно описывает термодинамические свойства реального газа в довольно широком интервале температур и давления.
Уравнение Ван-дер-Ваальса для одного моля:
Уравнение Ван-дер-Ваальса для ν молей:
Поправки Ван-дер-Ваальса:
Значения постоянных Ван-дер-Ваальса a и b зависят от природы газа, но не зависят от температуры, параметр a характеризует взаимодействие между молекулами на больших расстояниях – дальнодействие сил, параметр b характеризует взаимодействии на малых расстояниях – близкодействие сил взаимодействия.
Изотермы Ван-дер-Ваальса:
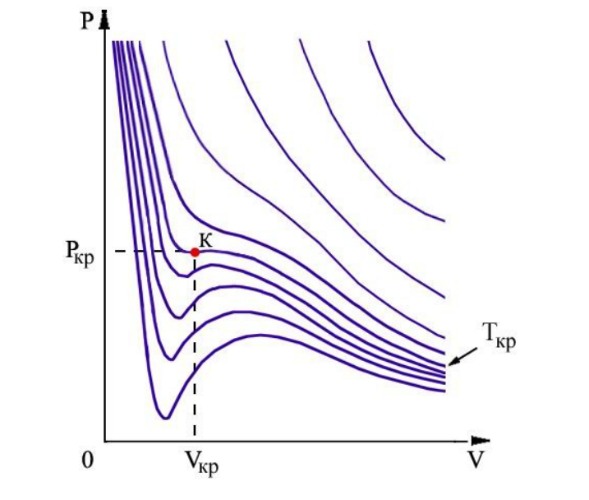
Изотерма Ван-дер-Ваальса
