Удельная теплота парообразования
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
График кипения
Рассмотрим графическое представление процесса нагревания жидкости — так называемый график кипения:
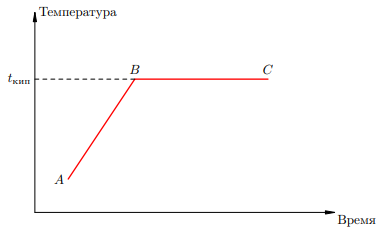
Рисунок 1. График кипения
Участок AB предшествует началу кипения. На участке BC жидкость кипит, её масса уменьшается. В точке C жидкость выкипает полностью. Чтобы целиком пройти участок BC, т. е. чтобы жидкость, уже доведённую до температуры кипения, полностью превратить в пар, к этой жидкости нужно подвести некоторое количество теплоты Qпар. Опыт показывает, что данное количество теплоты прямо пропорционально массе жидкости:
Коэффициент пропорциональности L называется удельной теплотой парообразования жидкости (при температуре кипения). Удельная теплота парообразования численно равна количеству теплоты, которое нужно подвести к 1 кг жидкости, взятой при температуре кипения, чтобы полностью превратить её в пар.
Так, при 100 ◦C удельная теплота парообразования воды равна 2300 кДж/кг. Интересно сравнить её с удельной теплотой плавления льда (340 кДж/кг) — удельная теплота парообразования почти в семь раз больше! Это и не удивительно: ведь для плавления льда нужно лишь разрушить упорядоченное расположение молекул воды в узлах кристаллической решётки; при этом расстояния между молекулами остаются примерно теми же (порядка размеров самих молекул). А вот для превращения воды в пар нужно совершить куда большую работу по разрыву всех связей между молекулами и удалению молекул на значительные расстояния друг от друга (гораздо большие, чем размеры молекул).
График конденсации
Процесс конденсации пара и последующего остывания жидкости выглядит на графике симметрично процессу нагревания и кипения. Вот соответствующий график конденсации для случая стоградусного водяного пара, наиболее часто встречающегося в задачах (рис.1).
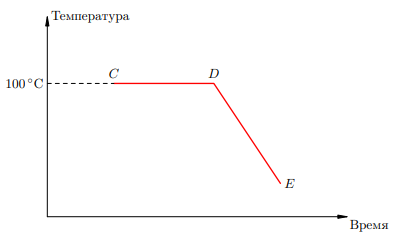
Рисунок 2. График конденсации
В точке C имеем водяной пар при 100 °C. На участке CD идёт конденсация; внутри этого участка — смесь пара и воды при 100 °C. В точке D пара больше нет, имеется лишь вода при 100 °C. Участок DE — остывание этой воды.
Опыт показывает, что при конденсации пара массы m (т. е. при прохождении участка CD) выделяется ровно то же самое количество теплоты Q = Lm, которое было потрачено на превращение в пар жидкости массы m при данной температуре.
Давайте ради интереса сравним следующие количества теплоты:
Q1, которое выделяется при конденсации 1 г водяного пара;
Q2, которое выделяется при остывании получившейся стоградусной воды до температуры, скажем, 20 ◦C.
Имеем:
Q1 = Lm = 2300000 · 0,001 = 2300 Дж;
Q2 = cm∆t = 4200 · 0,001 · 80 = 336 Дж.
Эти числа наглядно показывают, что ожог паром гораздо страшнее ожога кипятком. При попадании на кожу кипятка выделяется «всего лишь» Q2 (кипяток остывает). А вот при ожоге паром сначала выделится на порядок большее количество теплоты Q1 (пар конденсируется), образуется стоградусная вода, после чего добавится та же величина Q2 при остывании этой воды.
