Химическая связь в комплексных соединениях. Параметр расщепления. Спектрохимический ряд лигандов
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Теория кристаллического поля
Механизм образования связей в координационных соединениях объясняется чисто электростатическим взаимодействием между центральным ионом и лигандами;
Лиганды независимо от их реальной структуры представляются как точечные заряды (иногда — диполи);
Электронная конфигурация центрального иона (комплексообразователя) рассматривается в рамках квантово-химических представлений;
Теория кристаллического поля применима для описания химической связи координационных соединениях исключительно d- и f-элементов;
Представления о расщеплении энергетических уровней иона- комплексообразователя под влиянием лиганда — центральный пункт ТКП.
Расщепеление d-орбиталей комплексообразователя в электрическом поле лигандов в октаэдрических и тетраэдрических комплексах:
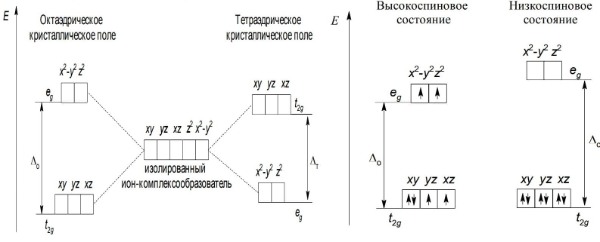
Энергия расщепления с увеличением степени окисления комплексообразователя увеличивается;
Энергия расщепления при переходе от 3d- к 4d- и 5d- элементам увеличивается.
При переходе от лигандов сильного поля к лигандам слабого поля энергия расщепления уменьшается > >> > > > > > >.
