Типы химических связей
НАВИГАЦИЯ ПО СТРАНИЦЕ
легко понять и запомнить
Химическая связь — то взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого.
Существуют её виды:
Ковалентная связь.
Ионная связь.
Металлическая связь.
Водородная связь.
Ван-дер-ваальсова (межмолекулярная) связь.
Ковалентная связь:
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорноакцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 1.1).
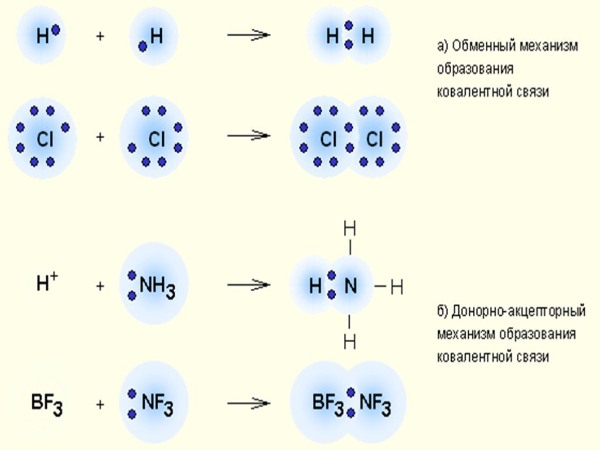
Рис. 1.1 Механизмы образования ковалентной связи
Характеристики связи
Кратность связей — между 2-мя атомами возможна только 1 сигма-связь, но наряду с ней между теми же атомами могут быть пи- и дельта-связь, что приводит к образованию кратных связей. Кратность определяется числом общих электронных пар.
Длина связи — межъядерное расстояние в молекуле, чем больше кратность, тем меньше ее длина.
Прочность связи — это количество энергии необходимое для ее разрыва.
Насыщаемость ковалентной связи проявляется в том, что одна атомная орбиталь может принимать участие в образовании только одной ковалентной связи. Это свойство определяет стехиометрию молекулярных соединений.
Направленность ковалентной — связи в зависимости от того, какую форму и какое направление имеют электронные облака в пространстве при их взаимном перекрывании могут образовываться соединения с линейной и угловой формой молекул.
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль/1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χA – χB) + 3,5(χA – χB)2, где χA и χB – электроотрицательности атомов А и В молекулы АВ.
Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей.
Ионная связь:
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом.
Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов.
Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщенности. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа.
В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул.
Металлическая связь:
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами.
Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Водородная связь:
Ее образование обусловлено тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S)
Водородные связи могут быть внутри и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 1.2).
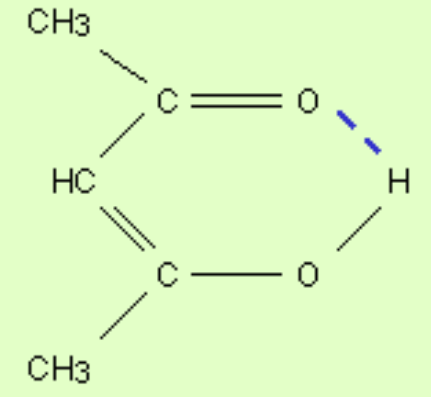
Рис. 1.2 Ацетилацетон
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
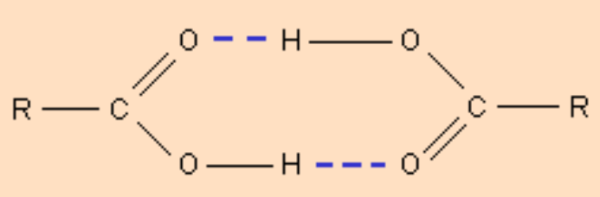
Рис. 3.4 Димеризация карборновых к-т
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения.
Ван-дер-ваальсова связь:
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь).
Энергия ван-дер-ваальсовой связи меньше водородной. Сила связи завит от массы молекул — чем масса больше, тем прочнее связь.
